论文推荐│红枣补血活性物质及补血作用机制研究进展
红枣补血活性物质及补血作用
机制研究进展
作 者
赵斐然,张紫怡,*魏冠棉,桑亚新
作者单位
河北农业大学食品科技学院
引用格式
赵斐然,张紫怡,魏冠棉,等.红枣补血活性物质及补血作用机制研究进展[J].农产品加工,2025,(20):100-106.
基金项目
“十四五”国家重点研发计划“乡村产业”专项项目(2022YFD1600400);河北农业大学引进人才项目(YJ2020030);河北农业大学基本科研业务费研究项目(KY2024047)。
摘 要
枣是常见的药食同源食品之一,具有补血益气之功效。枣中含有多糖、黄酮、维生素、膳食纤维、三萜和环磷酸腺苷等多种活性成分,在保健食品和生物医药领域具有广阔前景。通过综述红枣的造血功能、生物活性成分、补血作用机制,提出红细胞生成和保护、促进EPO生成、促进HIF-1α生成和刺激红细胞ATP酶4条对机体造血功能产生影响的途径。此外,探究了红枣中生物活性成分与补血作用机制之间的关系,并展望红枣中潜在补血活性物质进一步的研究方向,为红枣的高值化利用提供参考和新的思路。
关 键 词
红枣;补血;生物活性成分;药食同源
正 文
0 引言
红枣,起源于中国,是鼠李科枣属植物枣树的果实,数千年来一直被广泛应用于食品补充剂和中药补剂,具有极高的营养保健价值及药用价值。据最早的中医专书之一《神农本草经》记载,大枣是补血、提高睡眠质量、改善消化系统、延年益寿的上品药材之一[1]。目前,枣树在亚洲、欧洲和美洲等均有种植,中国是世界上最大的红枣生产国,红枣在我国的多个省份均有栽培,且新疆是红枣产量最大的省份,但国内对枣的加工利用仍处于早期阶段,目前仅有很小一部分为红枣加工企业利用,导致红枣资源浪费严重。随着对枣研究的不断深入,发现枣中含有多糖、多酚、黄酮、三萜、环磷酸腺苷、矿物质和维生素等多种生物活性物质[1-3]。红枣不仅可作为食品,还在造血系统[4]、神经系统、心血管系统及抗氧化和抗癌方面具有广泛的药理活性,因此被国家卫生健康委员会列为药食同源食品并受到越来越多关注。
贫血是人体外周血红细胞、血红蛋白数量减少并低于正常范围下限的一种临床症状,同时贫血也是世界上最常见的血液疾病,导致机体缺氧、免疫力下降、持续性乏力、发育不良并影响消化和神经系统。现代常使用的补血药物通常伴随着强烈的副作用,而枣作为药食同源食品,具有可长期使用、安全性高、毒性低等特点,常常出现在滋补气血的食品和中药调养处方中[5]。根据这一观点,研究人员通过构建小鼠血虚模型并试验发现枣对血虚模型小鼠具有促进造血功能[6]。然而,大多数研究对红枣的补血研究只停留在粗提物层面,红枣补血的物质来源和作用机制尚不确定,且并没有系统的探索红枣促进造血的功效和机制。因此,根据近年来国内外相关科研和文献资料报道[4-6],对枣中潜在的补血活性物质与造血功能之间的关系进行综述,归纳整理出红细胞生成和保护、促进EPO生成、促进HIF-1α生成和刺激红细胞ATP酶4条潜在造血作用机制,绘制信号作用通路图,为探明大枣促进造血的作用机制提供参考依据,并指出当前枣相关研究中存在的问题和未来研究方向,以期为大枣的深度开发利用和枣产业的可持续发展提供参考。
1 具有造血功能的潜在生物活性成分
1.1 黄酮
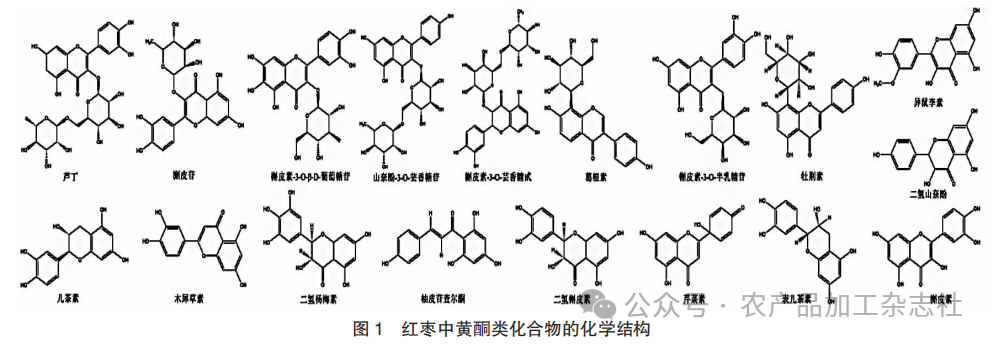
黄酮广泛存在于自然界植物中,是植物中的次级代谢产物,其结构以C6-C3-C6为基本骨架,2个苯环通过中间的三碳链相互连接。根据C3结构的氧化程度、成环个数和苯环的连接位点等特点,可将其分为黄酮和黄酮醇、黄烷酮和黄烷酮醇、异黄酮和异黄烷酮、黄烷和黄烷醇、查尔酮类、二氢查尔酮类、橙酮类等[7]。目前,已经从枣中分离并鉴定出多种黄酮类化合物[8-10],利用甲醇提取法从大枣、酸枣和基督刺枣3种枣品种中提取并鉴定出6种黄酮类化合物,包括槲皮素、山奈酚、根皮素衍生物等,且黄酮化合物在枣中含量占比较高[11];利用微波提取法在新疆和田骏枣中提取并鉴定出15种黄酮类物质,包括芦丁、儿茶素、牡荆素、槲皮苷、山奈酚、异鼠李素等[12],其中槲皮素、芦丁、葛根素和儿茶素是红枣中主要的黄酮类物质,且在抗炎、抗氧化、抗血栓和抗癌等方面具有一定功效[10],被认为是枣中具有较高生物活性的黄酮物质。促红细胞生成素(EPO)是促进红细胞生成的一种激素,可促进红系祖细胞增生,加速网织红细胞释放并提高红细胞膜抗氧化活性,被广泛应用于改善贫血[13]。细胞和动物试验发现,从枣中提取的黄酮葛根素能够刺激EPO的表达,使用剂量32.7 mg/kg的葛根素冻干粉能够显著提高缺血大鼠模型中EPO和EPO受体的表达水平[14],推测枣中黄酮物质可能是具有诱导EPO表达的活性物质之一。使用不同浓度的槲皮素处理HepG2肝癌细胞,其EPO mRNA表达量与槲皮素浓度呈剂量性增长,并缺氧诱导因子HIF-1α蛋白水平在10 μmol/L槲皮素处理后显著上升[15]。综上,推测黄酮可能通过HIF-1α蛋白的积累诱导EPO的表达,而富含上述黄酮物质的红枣被认为有较好的改善贫血作用。
红枣中黄酮类化合物的化学结构见图1。
1.2 多糖
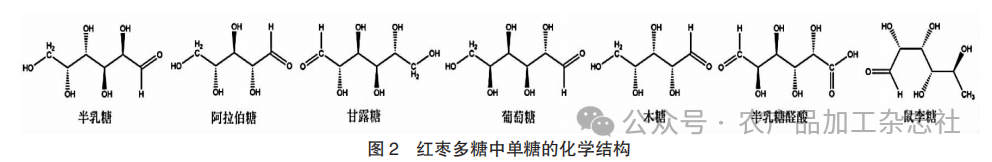
多糖是醛糖、酮糖通过糖苷键连接形成的天然大分子化合物,在生物界中广泛分布,是枣中的重要活性物质,多为酸性多糖和中性多糖,含量较高[16-17]。根据组成单糖的类别,可分为均聚多糖和杂多糖,均聚多糖由同一单糖组成,而杂多糖由多种单糖组成。自然界中多糖并不是单一存在,往往与其他非糖组分形成糖缀合物,并参与许多重要生命活动。枣中提取的多糖通常由5种单糖组成,通过水提醇沉法从骏枣中提取得到骏枣粗多糖HZPC,经DEAE-52型阴离子层析柱和Sephadex G-100型葡聚糖凝胶柱分离纯化获得精多糖HZPC-2,是由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和半乳糖醛酸构成[18];通过醇沉法在山西滩枣中提取出多糖ZSP,其主要为L -阿拉伯糖[19];用同样方法在冬枣中分离纯化得到均一多糖组分DPA和DPB,其单糖组成为阿拉伯糖、甘露糖、葡萄糖、半乳糖和鼠李糖[20]。多糖已被证明,具有多种生物活性,如促进造血[21]、抗氧化[22-23]、抗癌[24]、增强机体免疫[25]、降血糖[26]、抑制肿瘤细胞增殖[27]等。将不同质量浓度(30~200 μg/mL)的枣多糖作用于巨噬细胞并通过CCK-8法测定细胞增殖,发现多糖组分对诱导脾淋巴细胞增殖作用均呈剂量性依赖,并在200 μg/mL枣多糖处理下具有最高刺激作用,这表明枣多糖具有促进细胞增殖作用。另外,Ju-B-2是一种分子量超过2 000 ku的枣多糖,同样被证明具有细胞增殖作用,将10~100 μg/mL的Ju-B-2作用到脾细胞24 h并通过MTT法测定细胞增殖,结果发现枣多糖可诱导脾细胞增殖[28]。尽管一些研究表明,大枣多糖在预防贫血方面的有益作用,但其详细的作用机制尚不清楚,需要进一步研究可能涉及枣多糖处理体外或体内模型的信号通路。
红枣多糖中单糖的化学结构见图2。
1.3 三萜
三萜是枣中最具特色和最主要的活性成分之一,主要以三萜和皂苷的形式存在。三萜类化合物的侧链结构多样,可发生了较大的构象变化,如羟基化、环氧化、环化、碳还原、形成双键等。侧链的变化导致了三萜类化合物结构的多样性,因此三萜物质具有较强的药理活性,如抗癌[29]、抗炎[30]、抗糖尿病[31]等,这使得枣中的三萜类化合物成为开发多种新药的潜在靶点成分之一。三萜通常由30个碳原子组成,大多数三萜是由6个异戊二烯缩合而成,根据碳环结构,这些三萜类化合物可分为链状、单环、双环、三环、四环和五环三萜类化合物[32]。
红枣中三萜类化合物的化学结构见图3,红枣中的三萜类化合物及其类型见表1。
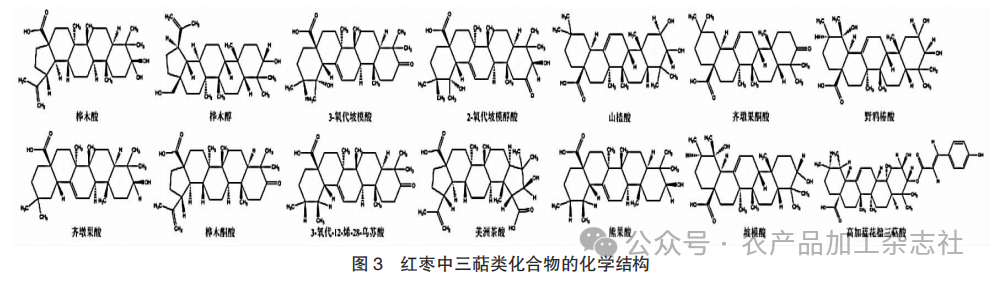
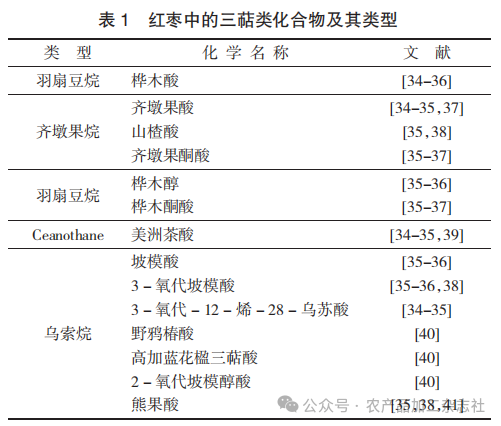
由表1可知,常见类型为羽扇豆烷、齐墩果烷、乌索烷等。目前,已经从枣中分离并鉴定出多种枣三萜化合物。
动物试验表明,质量浓度2 μg/mL灵芝三萜会对小鼠体内EPO表达产生影响,ELISA法检测发现其可显著增加小鼠外源性EPO分泌,通过煌焦油蓝染色法计数网织红细胞的数量,结果表明,质量浓度2 μg/mL灵芝三萜可诱导小鼠血液中网织红细胞数量提高9.8%。此外,还发现灵芝三萜可促进小鼠体内红细胞系统的成熟及内源性EPO的增加[33]。综上,推测枣果中的三帖类化合物可能对EPO分泌具有促进作用,但三帖类物质在补血方面研究较少,需要进行细胞或动物试验进一步研究三萜类化合物与补血作用之间的联系。
1.4 环磷酸腺苷
环磷酸腺苷(cAMP)是在人体内广泛的一种生理活性物质,由三磷酸腺苷在腺苷环化酶催化下生成,能调节细胞的多种功能活动,最早是从肝脏匀浆中提取出来,之后人们相继从植物和微生物中发现cAMP。cAMP在细胞内充当第二信使,广泛参与各种生理化学反应,含量极低,而枣中的cAMP含量远远高于其他果蔬。cAMP可刺激蛋白激酶A,磷酸化环磷腺苷效应元件结合蛋白CREB进而促进细胞的存活并调控多种细胞生长因子及趋化因子的表达[42],在体内可促进心肌细胞的存活,增强心肌细胞抗损伤、抗缺血和缺氧能力;通路可通过调控下游效应分子来促进血管内皮修复;可产生具有血管保护作用的NO发挥内皮保护作用,机体还可通过cAMP-PKA途径提高DDAH启动子活性、蛋白表达及酶活性,促进ADMA的失活,提高NO水平,同时促进内皮细胞生存和增殖,抑制ADMA诱导的内皮细胞凋亡。综上,大枣中的cAMP可能影响多种信号通路,并参与缺氧诱导因子(HIF)依赖性诱导EPO的产生,而EPO生成不足是肾脏性贫血的主要驱动因素之一[43],增加EPO在机体肝脏和肾脏中产生,对机体造血功能至关重要。
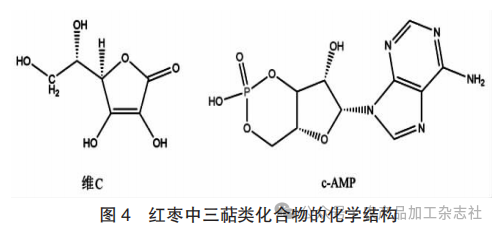
红枣中三萜类化合物的化学结构见图4。
1.5 维生素和铁元素
机体饮食摄入减少或吸收障碍会引起某些造血原料或造血辅助因子缺乏,如铁元素、维B12和维C缺乏造成的营养性贫血[44-45]。铁元素存在于所有活细胞内,参与体内细胞线粒体的电子传递、组织细胞物质与能量代谢和影响含铁酶、肌红蛋白的合成,因此铁元素亦为维持身体各系统正常生理功能所必需微量元素之一。人体十二指肠和空肠是铁的主要吸收部位,当机体对铁的需求与供给失衡时机体储存铁耗尽,会造成红细胞内铁元素缺乏,继而影响血红蛋白的生成、红细胞血氧交换,最终可引起缺铁性贫血[46]。维C能够将机体内铁元素还原为更容易被人体吸收的物质。人们摄入食物或药剂中的铁元素通常是以三价铁形式存在,而三价铁不易被人体吸收,需经过身体的消化和一系列的反应,转换为二价铁后才能够直接被身体吸收,而维C可促进三价铁还原为二价铁,进而达到促进身体对铁的吸收作用[44]。
缺铁性贫血属营养缺乏性贫血,补充铁剂是改善缺铁性贫血最安全、有效的方法。枣中富含铁和维生素,每100 g枣含有约0.48 mg铁和69 mg维C[47]。因此,每天摄入枣可增加铁和维生素的摄入,从而预防因缺铁或维生素而引起的贫血。
2 补血作用机制
2.1 促进红细胞生成和保护
红枣提取物对红细胞具有促进生成作用。枣多糖可有效改善贫血动物模型的贫血参数,通过放血和注射环磷酰胺法建立小鼠贫血模型,与模型组相比,枣多糖能够改善红细胞、血红蛋白和红细胞容积比水平的下降[48]。在另一项研究中,研究了枣多糖对结肠癌小鼠红细胞、血红蛋白和红细胞压积的影响,经枣多糖喂养70 d后的结肠癌小鼠的红细胞、血红蛋白和红细胞压积水平显著升高[49],表明红枣中的活性成分可能对患有贫血的癌症患者有益。此外,枣中多酚还对红细胞具有一定的保护作用。枣皮中富含多酚,其中香豆酸、儿茶素、表儿茶素和芦丁是枣皮中的主要酚类成分,具有较好的抗氧化活性[50]。试验使用过氧化氢建立红细胞氧化损伤模型,枣皮酚类提取物可改善过氧化氢对大鼠红细胞造成的损害,与对照组相比,用10 μmol/L游离或结合的红枣皮酚类物质处理的红细胞溶血水平分别降低了42.1%和44.0%,从枣皮中提取的游离或结合酚类物质同样抑制了高铁血红蛋白在红细胞中的形成[51],这些结果表明,大枣酚类提取物可有效防止红细胞溶血。综上,红枣中的活性成分能够有效促进红细胞、血红蛋白的生成,并保护红细胞,从而改善贫血。
2.2 促进EPO生成
红细胞生成被认为在造血过程中起着至关重要的作用,而红细胞生成又与红细胞特异性激素促红细胞生成素EPO水平密切相关。在低氧条件下未能上调EPO表达将导致贫血,而EPO能够刺激骨髓中的红细胞生成[52]。
EPO生成途径图见图5。
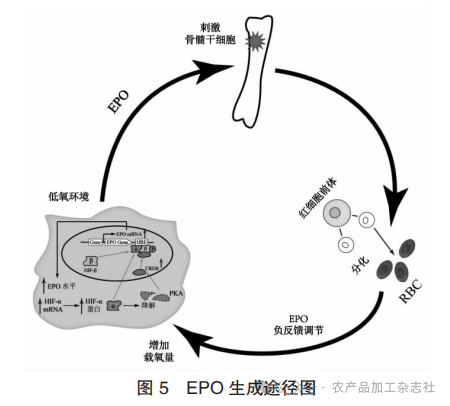
低氧环境会刺激机体EPO mRNA表达并上调EPO水平,进而刺激骨髓干细胞产生分化为成熟红细胞。根据上述试验结果,红枣改善贫血的有益作用可能与EPO介导的红细胞生成密切相关。大枣提取物(100~400 mg/kg)的摄入会增加血液循环中的 EPO水平,这表明大枣可能通过促进EPO的产生来提高红细胞水平。为支持这一观点,在肝癌细胞中应用质量浓度为0.75~3.00 mg/mL的大枣提取物,结果发现48 h内可促进EPO转录表达,且表达水平的增加呈剂量性依赖[53]。EPO由肾间质细胞或肝细胞产生,而肾功能障碍则会导致EPO生成不足和肾性贫血。在布洛芬诱导的肾损伤大鼠模型中,枣提取物(500 mg/kg)的摄入能够降低肌酐和尿素水平来改善肾功能,防止肾脏的组织病理学损害和贫血[54]。服用由大枣、黄芪、白术、山药和肉苁蓉等中药组成的补血中药汤剂可上调EPO的水平,提高血液内红细胞数量,改善慢性肾病贫血大鼠的肾功能和肾损伤[55]。目前,EPO改善贫血的作用机制尚不清楚,需要进一步的研究来证实红枣通过通路调节EPO的产生来改善贫血。
2.3 促进HIF-α生成
细胞对氧气的感知和反应是一个非常重要的过程,该过程主要由HIF及其调节子肿瘤抑制基因调控。
HIF-1α信号通路图见图6。

在机体缺氧时,HIF-1α无法被调节子识别,HIF-1α会产生积累并与HIF-1β形成二聚体,随后二聚体会进入核内,在核内其与辅因子组蛋白乙酰转移酶和DNA聚合酶复合物等相互作用,并与缺氧反应元件HRE结合,由此激活靶基因的转录。在低氧条件下,低氧诱导因子HIF可激活EPO的表达。因此,HIF靶向诱导促红细胞生成素的产生已被认为是改善贫血的一种新策略。EPO基因的启动子含有HRE,低氧介导的信号通路的激活刺激EPO表达[56]。用HRE启动子片段转染培养肝癌细胞,使用红枣提取物作用于细胞24 h,结果表明,红枣提取物对HRE的转录活性有一定的激活作用。为探讨HIF信号转导在枣提取物诱导HRE激活中的可能机制,将不同质量浓度的红枣提取液(0.75~3.00 mg/mL)作用于培养的肝癌细胞6 h,并利用聚合酶链式反应分析培养物中总RNA含量。结果表明,红枣提取物能刺激HIF-1α mRNA的表达,其诱导表达呈剂量依赖性,最高可增加约80%,同时培养物中的HIF-1α蛋白水平在处理后2 h开始增加,在处理后6 h后HIF-1α蛋白被诱导增加约150%。相关分析表明,红枣提取物能够诱导低氧诱导因子HIF的表达,进而刺激EPO水平的上升来改善贫血。
2.4 刺激红细胞ATP酶
ATP酶是能量的基本来源,对维持细胞完整性、电活动、代谢过程具有重要意义,能够作为红细胞损伤恢复能力和代谢紊乱的观测指标。Na+-K+-ATP酶能够将细胞膜内的Na+移出,并将细胞外的K+移入细胞膜内,从而保持细胞膜内高K+浓度和膜外高Na+浓度,Ca2+-ATP酶能够将Ca2+移出细胞外,从而维持细胞内Ca2+稳定。利用环磷酰胺和放血构建小鼠血虚模型后,细胞能量代谢和离子平衡被破坏,ATP减少,膜离子泵功能出现障碍,造成细胞内Na+、Ca2+堆积,膜内外离子异常分布。Ca2+离子浓度过高会导致自由基增多,损害线粒体功能和结构,对细胞组织造成损伤[48]。通过增加相应ATP酶活性能够调节离子异常分布,并减少细胞组织损伤。红枣提取物具有刺激红细胞ATP酶活性的作用,促进血虚动物骨髓核增殖,抑制胸腺和脾脏萎缩,显著改善骨髓造血功能[57]。
3 结语
红枣中富含黄酮、多糖、三萜酸、环磷酸腺苷和维生素等多种生物活性成分,且在促进造血、抗氧化、抗癌、增强机体免疫和降血糖等方面具有巨大开发前景。对枣中活性成分的补血功效及机制进行综述,并探究了红枣中生物活性成分对造血功能的潜在影响途径。目的是筛选出补血效果更好的生物活性成分,开发出更有效的功能性保健食品,实现红枣的高值化利用。尽管国内外研究对枣活性成分的成果显著,但在部分领域和研究还需要更多努力:①目前国内外对红枣的研究主要集中在生物活性成分方面,但作用机制尚未阐明,仍需对红枣具体成分进行药效预测,并通过细胞或动物试验进一步验证具体成分的补血作用机理,为开发补血保健食品建立理论基础;②枣的开发利用仍处于早期阶段,枣加工技术水平低、产品附加值低、健康产品少,利用生物技术手段对枣内补血活性物质进行深加工,开发出更多红枣功能产品有助于深化红枣在医药、食品领域中的应用,为实现红枣资源的高值化利用提供思路。
参考文献:
[1]JI X L,CHENG Y Q,TIAN J Y,et al. Structural characterization of polysaccharide from jujube(Ziziphus jujuba Mill.)fruit[J]. Chemical and Biological Technologies in Agriculture,2021,8(1):54-62.
[2]牛亚红,袁野,刘平,等. 枣中主要活性成分及其生物活性研究进展[J]. 中国果树,2021(8):5-11,18.
[3]ZHANG Y L,SUN X,VIDYARTHI S K.,et al. Active components and antioxidant activity of thirty-seven varieties of Chinese jujube fruits(Ziziphus jujuba Mill.)[J]. International Journal of Food Properties,2021,24(1):1479-1494.
[4]尚昱志,李陈玲,韦露秋,等. 基于网络药理学的大枣补血机制初探[J]. 中国食物与营养,2021,27(5):58-62.
[5]吴志豪,姜一陵,郑秦,等. 归脾汤对心脾两虚型缺铁性贫血患者携氧能力的影响[J]. 河北中医,2023,45(4):557-562.
[6]CHEN J P,LAM C T W,KONG A Y Y,et al. The extract of Ziziphus jujuba fruit(jujube)induces expression of erythropoietin via hypoxia-inducible factor-1alpha in cultured Hep3B cells[J]. Planta Medica,2014,80(17):1622-1627.
[7]刘秀敏. 和田骏枣中黄酮类物质的提取、组分分析及稳定性研究[D]. 石河子:石河子大学,2023.
[8]李宝剑,杨远贵,宋忠兴,等. 酸枣仁中黄酮类成分的研究进展[J]. 中南药学,2023,21(10):2690-2697.
[9]张媛媛,宋萌萌,张彬,等. 低共熔溶剂法提取枣渣中黄酮类物质[J]. 食品安全质量检测学报,2022,13(8):2658-2664.
[10]薛晓芳. 枣类黄酮特征分析及其代谢关键基因挖掘[D]. 晋中:山西农业大学,2021.
[11]PAWLOWSKA A M,CAMANGI F,BADER A,et al. Flavonoids of Ziziphus jujuba L. and Zizyphus spina-christi(L.)willd(Rhamnaceae)fruits[J]. Food Chemistry, 2009(4):858-862.
[12]吴东峰. 新疆骏枣的主要营养成分分析与品质评价[D]. 乌鲁木齐:新疆农业大学,2021.
[13]XU Y L,WANG B Y,ZHANG M M,et al. Carbon dots as a potential therapeutic agent for the treatment of cancer-related anemia[J]. Advanced Materials,2022,34(19):2200905-2200925.
[14]XUE Q,LIU Y,HE R,et al. Lyophilized powder of catalpol and puerarin protects neurovascular unit from stro-ke[J]. International Journal of Biological Sciences,2016, 12(4):367-380.
[15]NISHIMURA K,MATSUMOTO R,YONEZAWA Y,et al. Effect of quercetin on cell protection via erythropoietin and cell injury of HepG2 cells[J]. Archives of Biochemistry and Biophysics,2017(636):11-16.
[16]蔡雨晴. 金昌枣多糖提取分离、结构表征及生物活性的研究[D]. 阿拉尔:塔里木大学,2018.
[17]林夕梦. 碱提枣渣多糖的结构表征及抗氧化活性研究[D]. 杨凌:西北农林科技大学,2021.
[18]赵建成,刘慧燕,方海田. 骏枣多糖的分离纯化、结构表征及抗氧化活性研究[J]. 食品工业科技,2022,43(23):71-78.
[19]王东营. 陕北滩枣多糖的单糖组成分析及其药理功效研究[D]. 西安:陕西师范大学,2013.
[20]潘莹,许经伟. 冬枣多糖的分离纯化及抗氧化活性研究[J]. 食品科学,2016,37(13):89-94.
[21]CHEN M M,WU J J,SHI S S,et al. Structure analysis of a heteropolysaccharide from Taraxacum mongolicum Ha- nd.-Mazz. and anticomplementary activity of its sulfated derivatives[J]. Carbohydrate Polymers,2016(152):241-252.
[22]周蒙,罗鹏,毛若冰,等. 若羌灰枣多糖的磷酸化修饰及其抗氧化活性研究[J]. 粮食与油脂,2023,36(2):68-72,86.
[23]袁路路. 黑枣多糖结构鉴定及其抗氧化活性研究[D]. 泰安:山东农业大学,2021.
[24]关玉婷,温思萌,冯雪,等. 茯苓渣多糖组成分析及体外抗癌、免疫活性研究[J]. 食品工业科技,2022,43(21):381-387.
[25]LIU F,ZHANG Y,WANG F. Effect of jujube(Ziziphus jujuba)extract on intestinal flora,digestion,and immunity of rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture Reports,2021(21):100890-100899.
[26]杨兵. 拐枣多糖的分离纯化和结构解析及其降血糖活性研究[D]. 重庆:西南大学,2020.
[27]梁倩. 狗头枣多糖的抗肿瘤作用及其对染料木黄酮吸收转运的影响[D]. 西安:陕西师范大学,2021.
[28]ZHAO Z H,LI J,WU X M,et al. Structures and immunological activities of two pectic polysaccharides from the fruits of Ziziphus jujuba Mill. cv. jinsixiaozao Hort[J]. Food Research International,2006,39(8):917-923.
[29]MADASU C,KARRI S,SANGARAJU R,et al. Synthesis and biological evaluation of some novel 1,2,3-triazole hybrids of myrrhanone B isolated from Commiphora mukul gum re-sin:Identification of potent antiproliferative leads active ag-ainst prostate cancer cells(PC-3)[J]. European Journal of Medicinal Chemistry,2020(188):111974-111986.
[30]MALLAVADHANI U V,CHANDRASHEKHAR M,SHA-ILAJA K,et al. Design,synthesis,anti-inflammatory,cytotoxic and cell based studies of some novel side chain analogues of myrrhanones A & B isolated from the gum resin of Commiphora mukul[J]. Bioorganic Chemistry,2019(82):306-323.
[31]陈剑,吴月娴,吕寒,等. 枇杷叶中三萜酸类成分抗糖尿病及其并发症的体外活性研究[J]. 植物资源与环境学报,2020,29(3):78-80.
[32]OZDEMIR Z,WIMMER Z. Selected plant triterpenoids and their amide derivatives in cancer treatment:A review[J]. Phytochemistry,2022(203):113340-113348.
[33]李仲娟,杨朝令,杨细凤,等. 灵芝三萜对小鼠体内红细胞系统成熟的影响[J]. 时珍国医国药,2014,25(8):1861-1862.
[34]GUO S,DUAN J A,TANG Y P,et al. Triterpenoid acids from Ziziphus jujuba[J]. Chemistry of Natural Compoun-ds,2011,47(1):138-139.
[35]GUO S,DUAN J A,TANG Y P,et al. Triterpenoids from the fruits of Ziziphus jujuba var. spinosa[J]. Biochemical Systematics and Ecology,2011,39(4-6):880-882.
[36]FUJIWARA Y,HAYASHIDA A,TSURUSHIMA K,et al. Triterpenoids isolated from Ziziphus jujuba inhibit foam cell formation in macrophages[J]. Journal of Agricultural and Food Chemistry,2011,59(9):4544-4552.
[37]LEE S M,MIN B S,LEE C G,et al. Cytotoxic triterpenoids from the fruits of Ziziphus jujuba[J]. Planta Medica,2003,69(11):1051-1054.
[38]GUO S,DUAN J A,TANG Y P,et al. Characterization of triterpenic acids in fruits of Ziziphus species by HPLC-ELSD-MS[J]. Journal of Agricultural and Food Chemistry,2010,58(10):6285-6289.
[39]WU Y,CHEN M,DU M B,et al. Chemical constituents from the fruit of Ziziphus jujuba Mill. var. spinosa[J]. Biochemical Systematics and Ecology,2014(57):6-10.
[40]RUAN J Y,SUN F,HAO M M,et al. Structurally diverse triterpenes obtained from the fruits of Ziziphus jujuba Mill. as inflammation inhibitors by NF-κB signaling pathway[J]. Food & Function,2021(10):4496-4503.
[41]GUO S,TANG Y P,DUAN J A,et al. Two new terpenoids from fruits of Ziziphus jujuba[J]. Chinese Chemical Letters,2008,20(2):197-200,77.
[42]ARGYROUSI E K,HECKMAN P R A,PRICKAERTS J. Role of cyclic nucleotides and their downstream signaling cascades in memory function:Being at the right time at the right spot[J]. Neuroscience and Biobehavioral Reviews, 2020(113):12-38.
[43]HUANG S Y,JIANG X,CHEN Q G,et al. Jujube polysaccharides mitigated anemia in rats with chronic kidney disease:Regulation of short chain fatty acids release and erythropoietin production[J]. Journal of Functional Foods,2021(86):104673-104682.
[44]SOCHA D S,DE SOUZA S I,FLAGG A,et al. Severe megaloblastic anemia:Vitamin deficiency and other caus- es[J]. Cleveland Clinic Journal of Medicine,2020,87(3):153-164.
[45]HTUT T W,THEIN K Z,OO T H. Pernicious anemia:Pathophysiology and diagnostic difficulties[J]. Journal of Evidence Based Medicine,2021,14(2):161-169.
[46]KRISHNA T P A,CEASAR S A,MAHARAJAN T. Biofortification of crops to fight anemia:Role of vacuolar iron transporters[J]. Journal of Agricultural and Food Chemistry,2023,71(8):3583-3598.
[47]ZHANG Q,WANG L L,WANG Z T, et al. Variations of the nutritional composition of jujube fruit(Ziziphus jujuba Mill.)during maturation stages[J]. International Journal of Food Properties,2020,23(1):1066-1081.
[48]苗明三,苗艳艳,方晓艳. 大枣多糖对大鼠气血双虚模型胸腺、脾脏中组织形态及骨髓象的影响[J]. 中药药理与临床,2010,26(2):42-44.
[49]SRINIVASAN P,WANG H W,SE P C,et al. Dietary Ziziphus jujuba fruit attenuates colitis-associated tumorigenesis:A pivotal role of the NF-kappaB/IL-6/JAK1/STAT3 pathway[J]. Nutr Cancer,2020,72(1):120-132.
[50]梁荣,吴继红,周祥山,等. 枣果的抗氧化活性成分研究进展[J]. 食品研究与开发,2019,40(24):211-218.
[51]CAO D D,LI H,CHE H L,et al. Antioxidant properties of phenolic extracts from dried jujube(Ziziphus jujuba Mill.)peel against oxidative damage in erythrocytes[J]. Current Topics in Nutraceutical Research,2011(4):147-154.
[52]NAKAI T,IWAMURA Y,KATO K,et al. Drugs activating hypoxia-inducible factors correct erythropoiesis and hepcidin levels via renal EPO induction in mice[J]. Blood Advances,2023(15):3793-3805.
[53]LAM C T W,CHAN P H,LEE P S C,et al. Chemical and biological assessment of jujube(Ziziphus jujuba)-containing herbal decoctions:Induction of erythropoietin expression in cultures[J]. Journal of Chromatography B-Analytical Te-chnologies Biomedical and Life Sciences,2016(26):254-262.
[54]AWAD D S,ALI R M,MHAIDAT N M,et al. Ziziphus jujuba protects against ibuprofen-induced nephrotoxicity in rats[J]. Pharmaceutical Biology,2014,52(2):182-186.
[55]CHEN J P,WANG F C,HUANG S Y,et al. Jian-Pi-Yi-Shen decoction relieves renal anemia in 5/6 nephrectomized rats:Production of erythropoietin via hypoxia inducible factor signaling[J]. Evidence-Based Complementary and Alternative Medicine,2019(19):2807926-2807936.
[56]SCHODEL J,RATCLIFFE P J. Mechanisms of hypoxia si-gnalling:New implications for nephrology[J]. Nature Reviews Nephrology,2019,15(10):641-659.
[57]苗明三,苗艳艳,孙艳红. 大枣多糖对血虚大鼠全血细胞及红细胞ATP酶活力的影响[J]. 中国临床康复,2006(11):97-99. ◇